近年来,分子互作分析仪市场涌现出很多新品牌、新产品参与市场之间的竞争。仪器信息别策划了分子互作分析仪专题。本期,我们特别邀请到赛多利斯生物分析高级应用经理陈涛先生谈一谈对分子互作分析仪的看法。
近年来,分子互作分析仪市场涌现出很多新品牌、新产品参与市场之间的竞争,技术多元化,“百花齐放”。
目前国内外分子互作分析仪厂商已涌现近20余家,为帮助广大科研工作者了解前沿分子互作分析技术、增强业界有关人员之间的信息交流,同时也为用户更好的提供更丰富的分子互作分析产品与技术解决方案,仪器信息别策划了《“百舸争流”,谁将成为下一代金标准?——分子互作技术与应用进展》

陈涛,赛多利斯生物分析高级应用经理,从事生物层干涉技术(BLI)类产品的技术上的支持12年,有着丰富的Octet
使用和troubleshooting经验,承担了国内华东地区现有客户的售后支持,并多次举办了在线培训和其他各种各样的形式的培训班。在他的支持下,目前仅国内利用生物层干涉技术发表的SCI就有500余篇,是互作技术领域非常知名的“陈老师”生物层干涉(BLI)技术是一种非标记技术,可实时提供高通量的生物分子相互作用信息。此技术采用”浸入即读”的生物传感器对样品直接进行仔细的检测,无需对检测样品做任何荧光或同位素标记【1】,也不存在流路系统,以此来实现更简便、更快速的分子互作定量分析。2020年,BLI技术被收录于美国药典1108章节,成为药物结合活性分析的标准方法之一。作为将BLI技术应用于分子互作检测的开创者和引领者,赛多利斯Octet®分子互作分析系统被大范围的应用于包括蛋白、抗体、病毒颗粒、疫苗、多肽、小分子以及DNA/RNA等各类生物分子间相互作用分析。
BLI技术的动力学分析可用于检测相互作用的亲和力以及可逆的非共价结合的结合常数(kon)、解离常数(k
)以及亲和力常数(KD)。典型的非共价结合由静电作用、氢键、范德华力和疏水作用组成。分子之间的特异性相互作用对生物学的许多过程以及药物研发至关重要【2】。凭借高通量、非标记、实时定量且无液路的特点,Octet®在大分子相互作用分析和生物药研发领域具有突出优势。慢慢的变多的高分文献及应用实例证明了BLI技术在小分子、化合物片段、未知样品垂钓、竞争分析等应用中表现优异,传感器分析模式也更加容易开发灵活和创意的检测方案。
基于生物传感器的片段化合物筛选是药物研发过程中一个很具有价值的工具。这种方法优于许多其他的生化方法,因为苗头化合物可有效地通过具体的结合图谱以及响应值从非特异性或非理想的相互作用中区分开来,以此来降低假阳性。BLI技术通过监测生物分子结合导致的光的干涉图谱的变化实现分子间的相互作用的实时检测。Charles A. Wartchow等
将重组表达纯化得到AVI-Tag生物素标记的蛋白或通过体外的方式标记生物素(biotin-LC-LC-NHS)固化至链酶亲和素传感器上。通过缓冲液建立基线噪音信号,以基线倍标准差为阈值筛选苗头化合物(图1)。使用了包含6500种化合物的片段文库,以BCL-2、JNK1、eIF4E等蛋白为靶点进行了筛选,比较了这些靶点的苗头化合物的比率。
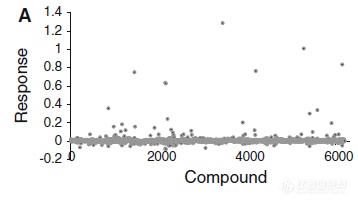
根据化合物的信号值筛选苗头化合物【3】Francesca E. Morreale等【4】同时使用差示扫描荧光(DSF)和BLI技术筛选E2泛素连接酶Ube2T的抑制剂。将Ube2T固化在链霉亲和素传感器上,对片段库的化合物进行筛选。利用DSF方法筛选出4种化合物,而采用BLI方法也筛选出4种化合物,其中有2种是同时用两种方法都筛选了出来。所有六种化合物用核磁共振(NMR)进行了验证并确认这些化合物在靶点蛋白上的结合位点。
新冠病毒的RNA依赖的RNA聚合酶(RdRp)是理想的抗病毒靶点。中国医学科学院的研究人员【5】首先通过基于结构的虚拟筛选,选择结合最强的几十个hits,通过Octet高通量分析这些化合物与靶点SARS-CoV-2 RdRp的结合活性,发现Corilagin (RAI-S-37)作为SARS-CoV-2 RdRp的非核苷抑制剂,KD值达到0.54 μM。在细胞外和细胞活性检测中均能有效抑制聚合酶活性。Corilagin拥有非常良好的安全性和药代动力学的数据,使其成为新冠肺炎潜在的治疗药物。
化合物药物与靶点的动力学参数是很重要的表征参数,直接影响到了化合物在体内的半衰期以及所需的药物剂量。苗头化合物的亲和力通常比较低(>
10uM),而通过修饰改造后的小分子化合物的亲和力可以1 μm级别。多数情况,将蛋白靶点固化在传感器上和不同浓度梯度的化合物作为分析物。
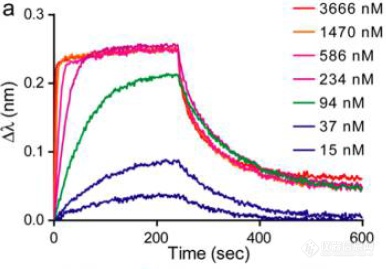
Leah N. Makley等将突变的晶体蛋白cryAB固化在链霉亲和素传感器上,用BLI技术检验测试化合物与cryAB的相互作用,测得KD为29 μM。用差示扫描荧光(DSF)也观测到不同浓度的该化合物对cryAB熔点的改变。
考虑到空间位阻与修饰后化合物的活性,一般在化合物的非活性基团上偶联一个生物素,再将化合物固化在链霉亲和素传感器上,并且生物素与小分子之间有10个碳的连接臂。Basudeb Maji等【7】利用BLI技术筛选cas9的小分子抑制剂,并且合成了生物素化的小分子,固化在链霉亲和素传感器上,然后和七个浓度的Cas9/gRNA复合物结合,测得亲和力为700 nM(图3)。

如果化合物有氨基,也可以用氨基偶联传感器对化合物进行固化。Terry F. McGrath等【8】将软骨藻酸(Domoic acid),固化在氨基偶联传感器上,用竞争法检测软骨藻酸的浓度,灵敏度能够达到2 ng/mL。
另外,化合物也可以偶联在诸如牛血清白蛋白(BSA)等载体蛋白上,然后疏水固化在传感器上。Melanie Sanders等【9】将鸡卵白蛋白(OVA)偶联的呕吐毒素固化在疏水传感器上,与呕吐毒素的抗体反应,其亲和力在pM级别。
如果已知某化合物与蛋白结合,需要观察另一个化合物是否阻断这种结合。可以借鉴前面“化合物为固化物的亲和力检测”部分将化合物进行固化,然后检验测试另一个化合物与蛋白的混合物。
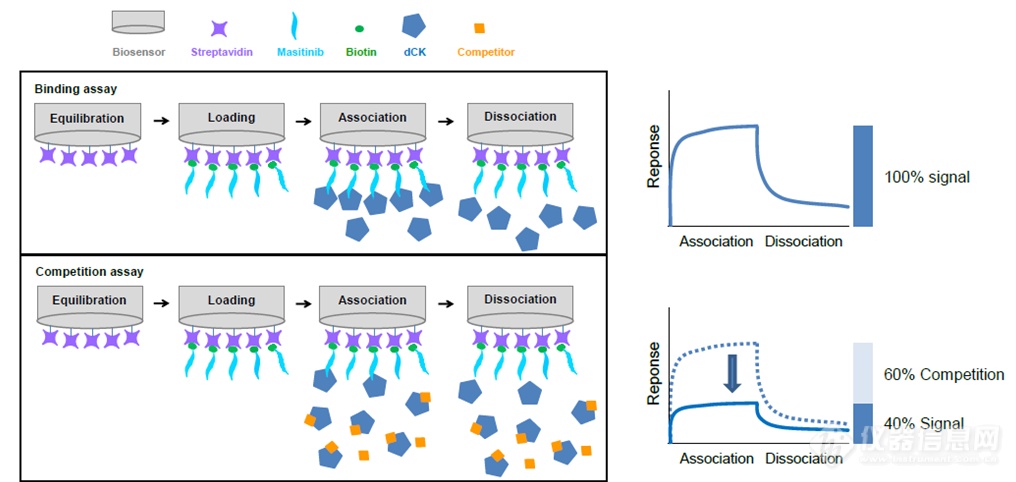
通过竞争实验可见,Masitinib与Imatinib几乎完全竞争,这证明了他们的结合位点一致。但是与核苷类化疗药物(吉西他滨、阿糖胞苷和地西他滨)竞争关系不明显。BLI技术还可以检测化合物是不是能够阻断受体配体的结合,并计算IC50。Zhu J 等
用BLI技术检验测试化合物NUCC-555对激活素(activin)和其配体结合的影响。将激活素配体ALK4-ECD-Fc固化至ProA传感器上,检测激活素与不同浓度NUCC-555的混合物。随着NUCC-555的浓度提高,由于NUCC-555与ALK4-ECD-Fc竞争结合激活素导致激活素与ALK4-ECD-Fc结合信号降低,IC50大概为1.6 μM。由此证明NUCC-555是选择性的竞争抑制激活素和其配体的结合。
BLI技术不但可以用来检测化合物与蛋白、细胞的相互作用【12】,也可以检测化合物与DNA/RNA
等其他物质的相互作用。应用BLI技术能灵活的设计相互作用实验,比如将小分子固化或者蛋白质固化。固化方式能根据蛋白所带的标签决定:组氨酸融合标签可以用NTA传感器或者已经固化了组氨酸标签抗体的传感器;如果蛋白带有生物素标签,可以用链霉亲和素传感器。一般来说,为客服空间位阻和获得比较高的固化密度,建议选择链霉亲和素传感器固化蛋白。一般分析物必须了解到明确的分子量和摩尔浓度才可以获得结合常数(ka)和亲和力常数(KD)。分析物的分子量检测下限约为150 Da, Chenyun Guo等【15】用BLI技术成功检测了分子量142 Da的化合物并且获得了可观的信号(>
0.1 nm)。总之,BLI技术能实现对相互作用更加定量化地测定,很适合亲和力比较低的化合物检测。化合物解离比较快,传统方法有洗涤等步骤,会造成结合的小分子被洗掉后产生假阴性结果。另外传统方法多数需要标记,可能改变靶点分子的构象,产生假阳性结果。BLI技术的非标记和实时检测能够克服传统方法的弊端,因此,小分子相互作用检测结果更真实可靠。参考文献:



